(2024·四川雅安高一月考)化学反应伴随着能量的变化,下列实验过程的能量变化相同的是( )
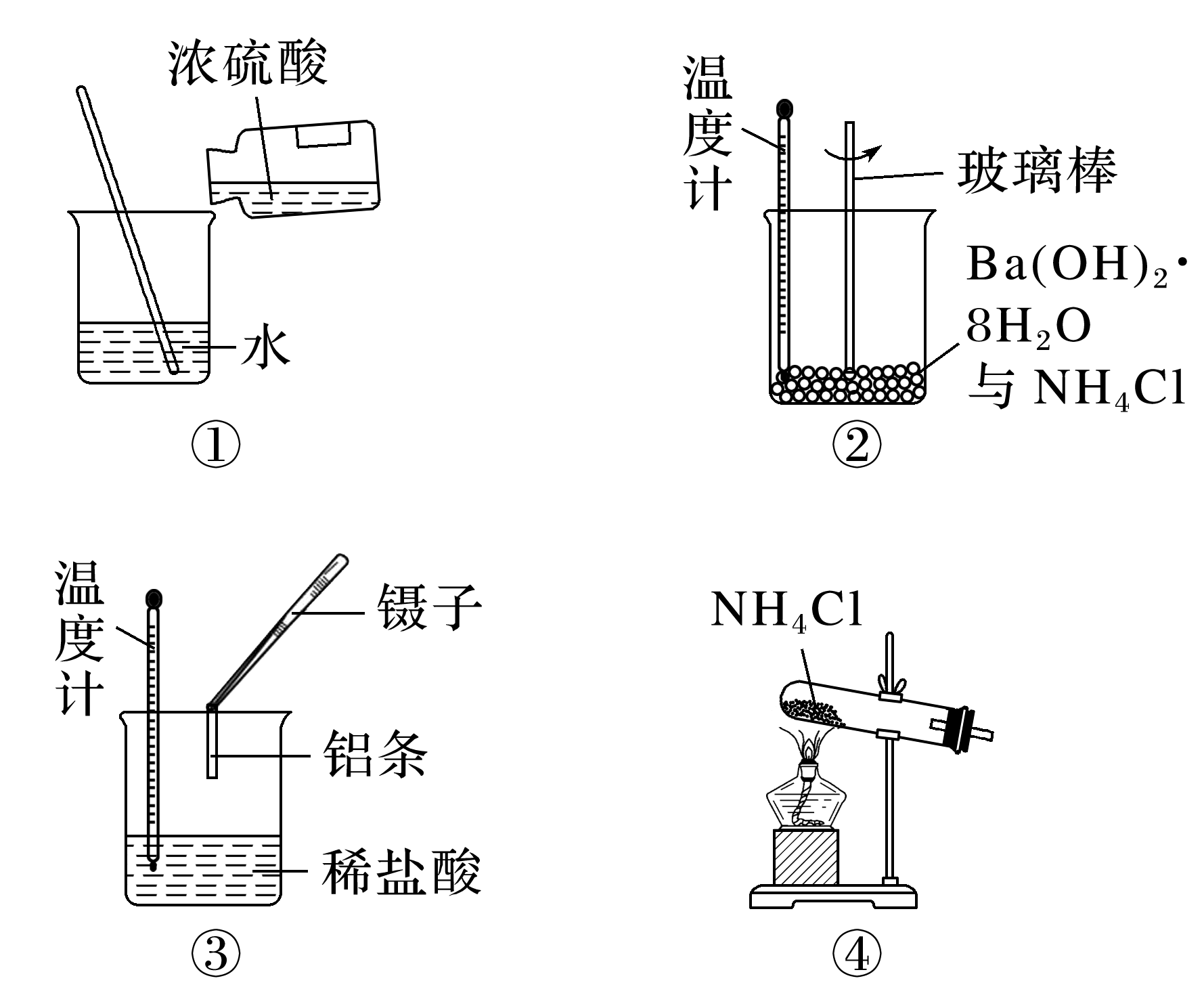
- A: ①②
- B: ③④
- C: ②③
- D: ②④
①是放热过程,是物理变化,③是放热反应,②④是吸热反应,故选D。
(2024·吉林四平高一段考)下列有关化学反应与能量变化的说法正确的是( )
自发进行的氧化还原反应可以设计成原电池,该反应属于非氧化还原反应,不能设计成原电池,A错误;化学变化中的能量变化形式有热能、光能、电能等,B错误;燃料电池是将化学能转化为电能的装置,C错误;等质量的硫蒸气能量高于硫粉,分别与氧气反应生成SO2气体,硫蒸气放出的热量多,D正确。
(2023·南昌高一检测)下列事实或做法与化学反应速率无关的是( )
降低温度,反应速率减慢,所以温度降低能减慢食物的腐败速率,故A不选;用铁触媒作催化剂合成氨,催化剂能增大反应速率,故B不选;增大反应物接触面积,能增大反应速率,将煤块粉碎能增大反应物接触面积,所以能加快反应速率,故C不选。
化学反应速率和化学反应限度是化工生产研究的主要问题之一,下列对化学反应速率和反应限度的认识错误的是( )
使用催化剂是为了增大反应速率,提高单位时间内产物产率,提高生产效率,故A正确;任何可逆反应都有一定的限度,当外界条件改变时,限度是可以改变的,故C正确;影响化学反应速率的客观因素是温度、浓度、压强和催化剂等条件,故D正确。
(2024·四川雅安高一月考)化学反应伴随着能量的变化,下列实验过程的能量变化相同的是( )

①是放热过程,是物理变化,③是放热反应,②④是吸热反应,故选D。
(2024·北京顺义月考)某化学兴趣小组,使用相同的铜片和锌片为电极,探究水果电池水果的种类和电极间距离对电流的影响(实验装置如图),实验所得数据如下:
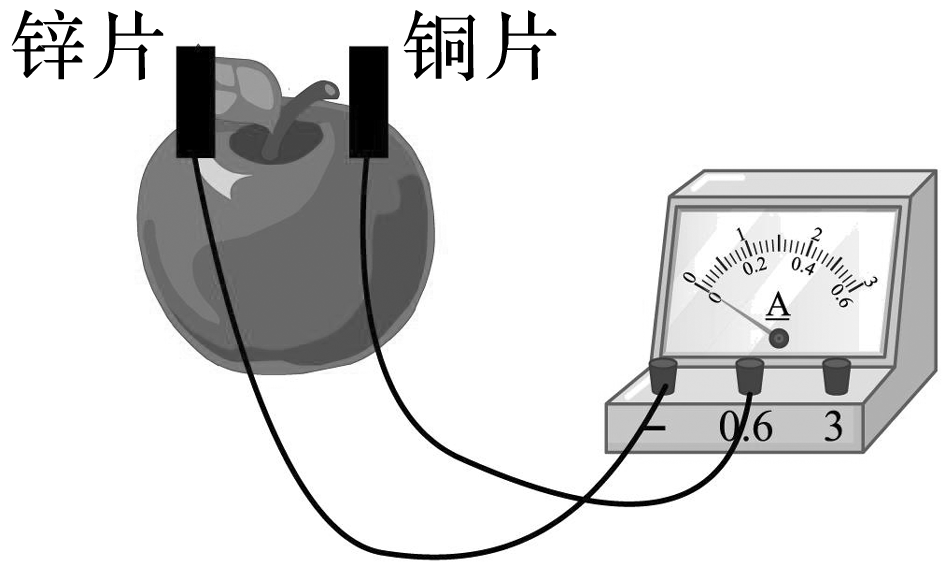
电池工作时,下列说法不正确的是( )
电子从锌片经导线流向铜片,而不能经水果流向铜片,故选B。
(2023·石家庄高一期末)对于在恒容密闭容器中进行的反应:C(s)+H2O(g)![]() CO(g)+H2(g),下列说法错误的是( )
CO(g)+H2(g),下列说法错误的是( )
恒容条件下,充入少量He,各物质的浓度不变,反应速率不变,A错误;v正(CO)=v逆(H2O),说明正、逆反应速率相等,反应达到平衡状态,B正确;其他条件不变,增加C(s)的质量不能改变其浓度,故反应速率不变,C正确;该反应中C(s)是固体,平衡建立过程中,气体总质量和总物质的量不断变化,混合气体的平均相对分子质量不断变化,当其不变时,该反应达到平衡状态,D正确。
(2023·大理白族自治州民族中学高一期中)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
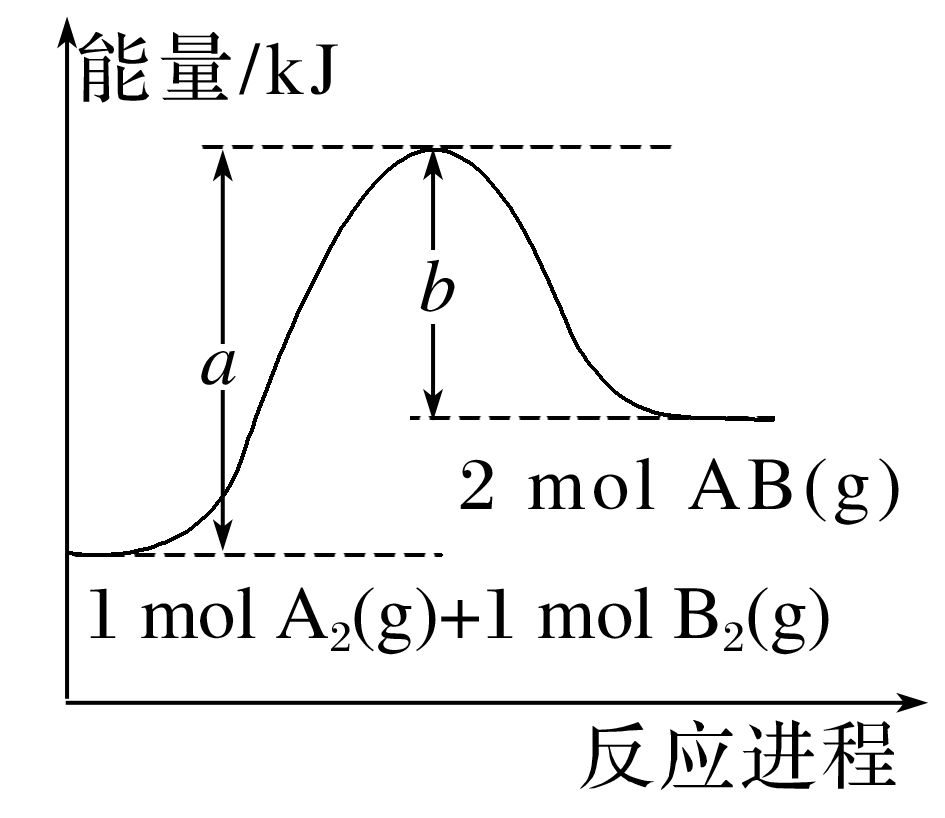
由图可知,生成物的总能量高于反应物的总能量,该反应为吸热反应,A、D项错误;断裂化学键吸收能量,根据图示可知断裂1 mol A—A和1 mol B—B吸收a kJ能量,B项错误;该反应为吸热反应,1 mol A2(g)和1 mol B2(g)反应生成2 mol AB(g)吸收的热量为(a-b) kJ,C项正确。
(2024·河北沧州高一段考)某同学设计了如下实验来探究化学反应的限度:
ⅰ.取3 mL 0.1 mol·L-1KI溶液于试管中,向其中加入10滴0.1 mol·L-1FeCl3溶液,振荡;
ⅱ.用滴管取适量反应后的溶液于点滴板上,向其中滴加1~2滴淀粉溶液,观察到溶液变蓝;
ⅲ.用滴管取适量步骤ⅰ反应后的溶液于点滴板上,向其中滴加1~2滴15%KSCN溶液,观察到溶液变红。下列说法错误的是( )
3 mL 0.1 mol·L-1KI溶液和10滴0.1 mol·L-1FeCl3溶液混合,I-过量,若不是可逆反应,Fe3+全部转化为Fe2+,则溶液中无Fe3+,实验ⅲ现象说明Fe3+部分转化为Fe2+,则该反应存在限度,步骤ⅱ中现象说明有碘单质生成,故选B。
(2024·长沙高一期中)一种原电池的简易装置如图所示,NA为阿伏加德罗常数的值,下列说法正确的是( )
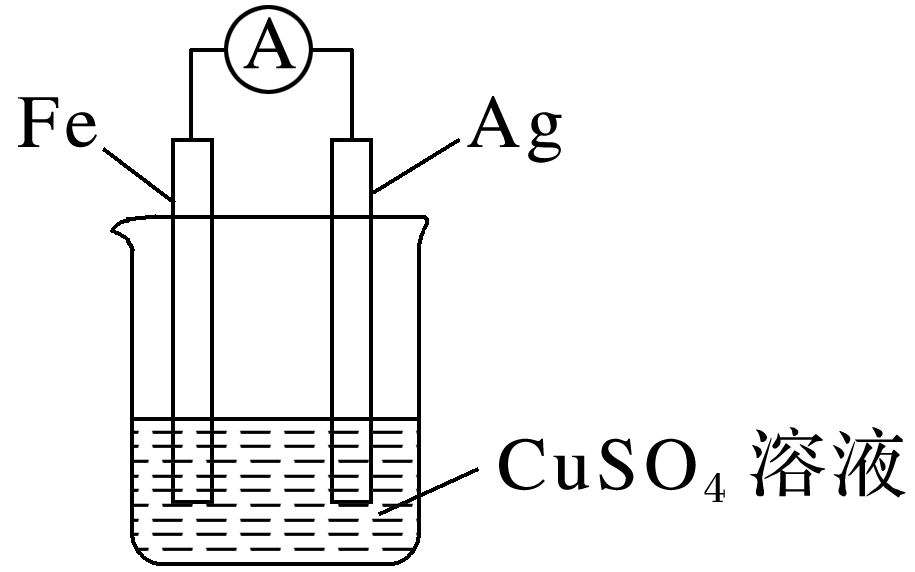
银是正极,溶液中的阳离子向银电极移动,A错误;电子的移动方向为铁电极→导线→银电极,B错误;负极电极反应式为Fe-2e- ===Fe2+,C错误;正极电极反应式为Cu2++2e-===Cu,质量增加6.4 g,即生成1 mol铜,外电路转移电子数目为0.2NA,D正确。
(2024·西安高一期中)某小组利用图1装置探究X和Y的反应。
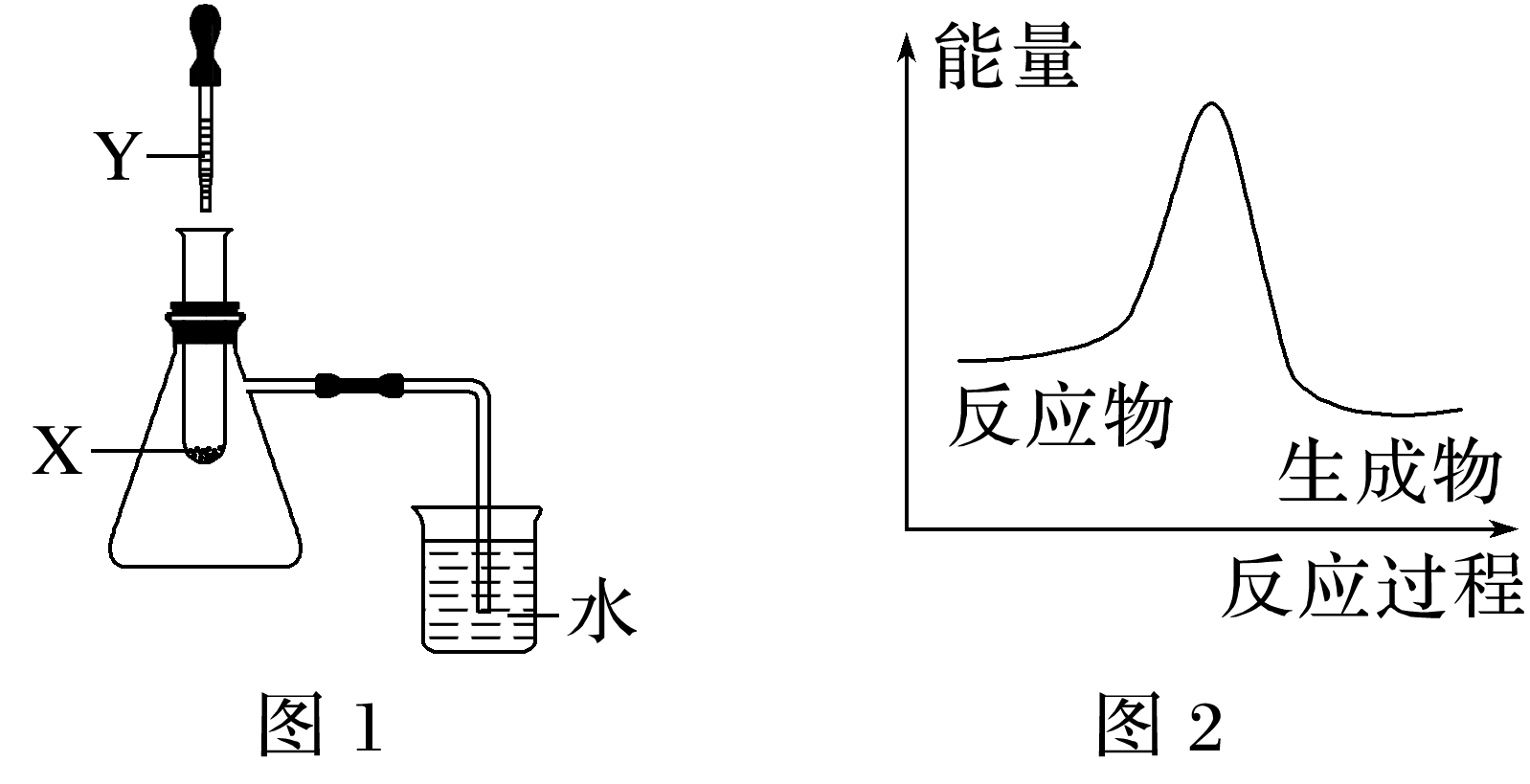
下列叙述正确的是( )
导管形成一段液柱,说明该反应为吸热反应,而图2为放热反应,故能量变化与图2不符,A错误;烧杯中产生气泡,说明反应放热,符合图2所示能量变化,B正确;烧杯中产生气泡,则X和Y的反应是放热反应,C错误;烧杯中产生气泡,说明反应放热,则该反应的反应物断键吸收的能量低于生成物成键释放的能量,D错误。
N2O5在CCl4中的分解反应为2N2O5(CCl4) ―→2N2O4(CCl4)+O2(g),N2O5和分解产物N2O4均能溶解在CCl4中。不同时刻测得氧气体积和N2O5浓度变化如表所示。下列说法不正确的是( )
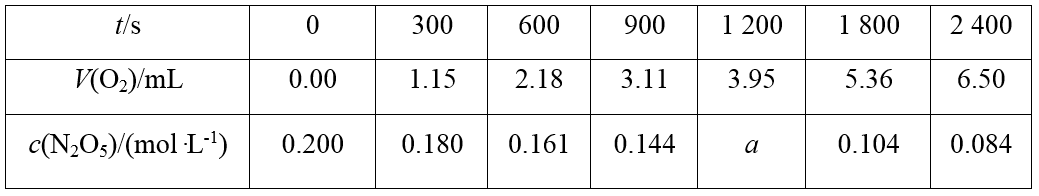
该反应在CCl4中进行,则可以利用O2不溶于CCl4的性质,准确测定O2的体积随时间变化的关系,进而研究化学反应速率,A正确;0~1 200 s内,v(N2O5)=v(N2O4)=5.83×10-5 mol·L-1·s-1,则Δc=v·Δt=5.83×10-5 mol·L-1·s-1×1 200 s≈0.070 mol·L-1,则a≈0.200-0.070=0.130,B正确;600~900 s内,v(N2O5)==≈5.67×10-5 mol·L-1·s-1,1 800~2 400 s内,v(N2O5)==≈3.33×10-5 mol·L-1·s-1,故600~900 s N2O5的平均反应速率大于1 800~2 400 s的平均反应速率,C错误;由表可知,随着N2O5浓度的减小,单位时间O2体积的增加量减小,D正确。
普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一特点,科学家们发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的化学方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是( )
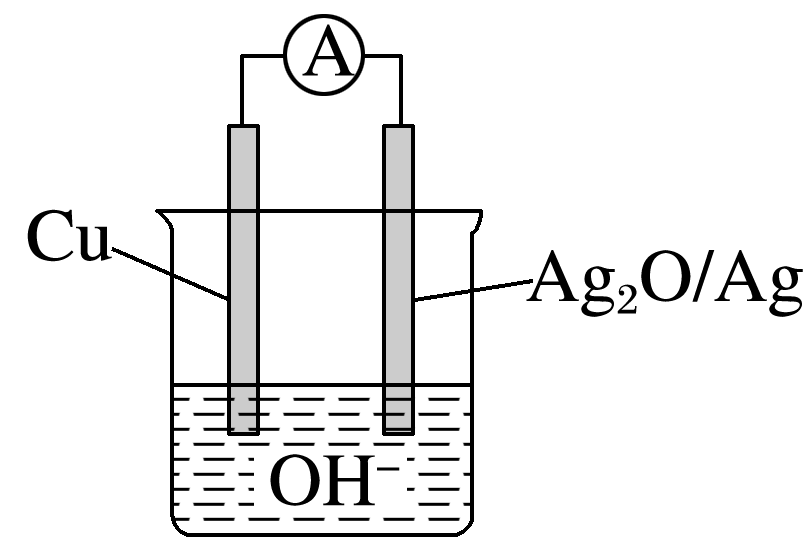
由题意知,该装置构成了原电池,原电池工作过程中发生了自发的氧化还原反应,该反应为放热反应,反应物的总能量高于生成物的总能量,A错误;Cu在反应中失电子,作原电池的负极,所以Ag2O/Ag电极为正极,B正确;电流由正极流向负极,所以电流方向为Ag2O→Cu,C错误;原电池工作时,电解质溶液中的阴离子移向负极Cu极,D错误。
(2024·江苏徐州高一期中)把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
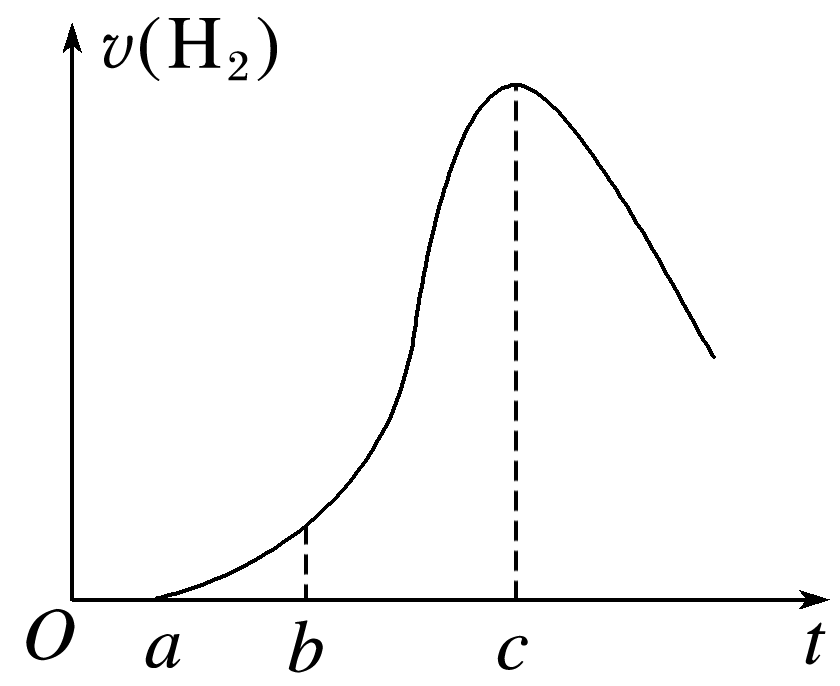
久置的铝片表面有一层致密的Al2O3薄膜,Al2O3先与硫酸反应得到盐和水,无氢气放出,A正确;该反应不是可逆反应,没有平衡状态,C错误。
一种新型燃料电池,它以多孔镍板为电极,两电极插入KOH溶液中,向两极分别通入乙烷和氧气,其电极反应式为C2H6+18OH--14e-===2C+12H2O,2H2O+O2+4e-===4OH-。有关此电池的推断正确的是( )
正极生成了OH-,故正极区的pH逐渐增大,A错误;乙烷在负极发生氧化反应,氧气在正极发生还原反应,根据电池的总反应:2C2H6+7O2+8OH-===4C+10H2O可知,正极与负极上参加反应的气体的物质的量之比为7∶2,B正确;原电池中,负极发生氧化反应,根据电极反应式可知,乙烷在负极失电子,发生氧化反应,C错误;原电池中,阴离子向负极移动,因此电解质溶液中的OH-向负极移动,D错误。
流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4===CuSO4+PbSO4+2H2O。下列说法正确的是( )
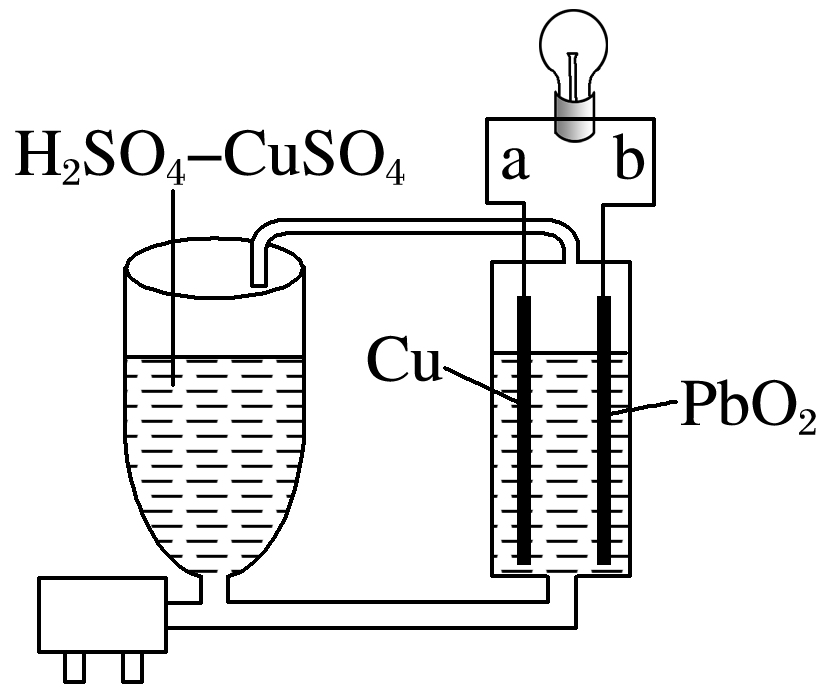
根据电池总反应Cu+PbO2+2H2SO4===CuSO4+PbSO4+2H2O可知,铜失电子发生氧化反应为负极,PbO2得电子发生还原反应为正极,则b为正极,a为负极,故A错误;内电路中是离子的定向移动,而不是电子的定向移动,故B错误;b极的电极反应式为PbO2+4H++S+2e-===PbSO4+2H2O,故C错误;根据电池总反应Cu+PbO2+2H2SO4===CuSO4+PbSO4+2H2O可知,随放电的进行硫酸不断被消耗,即调节电解质溶液的方法是补充H2SO4,故D正确。
某实验探究小组研究320 K时N2O5的分解反应:2N2O5![]() 4NO2+O2。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
4NO2+O2。如图是该小组根据所给表格中的实验数据绘制的。下列有关说法正确的是( )
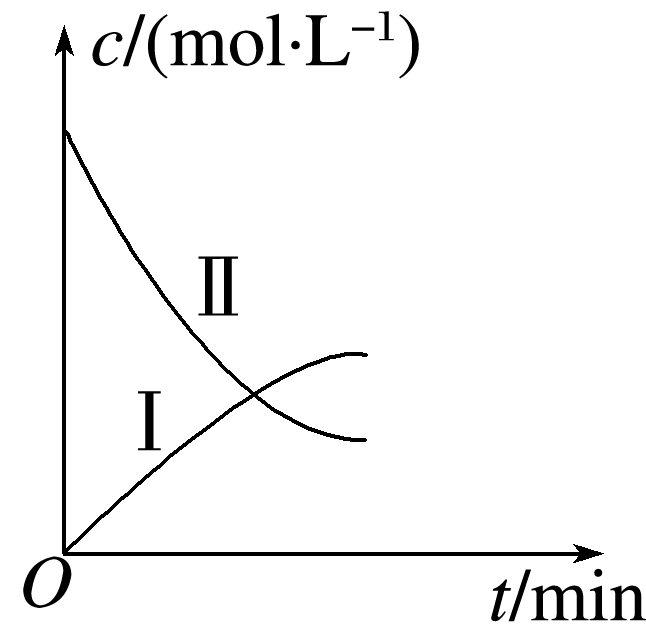
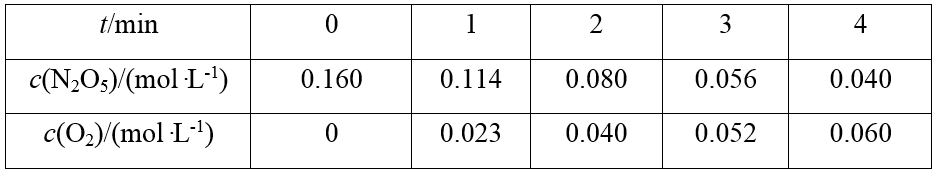
结合表格中N2O5和O2的初始浓度可知曲线 Ⅰ、Ⅱ 分别是O2、N2O5的浓度变化曲线,A、B项错误;利用表格中数据进行计算,无论是用N2O5的浓度变化,还是用O2的浓度变化得出的反应速率都随着反应的进行而减小,而随着反应的进行,N2O5的浓度减小,O2的浓度增大,C项正确、D项错误。
(2024·合肥高一期中)研究化学能与热能、电能的转化具有重要价值。
(1)下列化学反应过程中的能量变化符合图示的是 (填序号)。
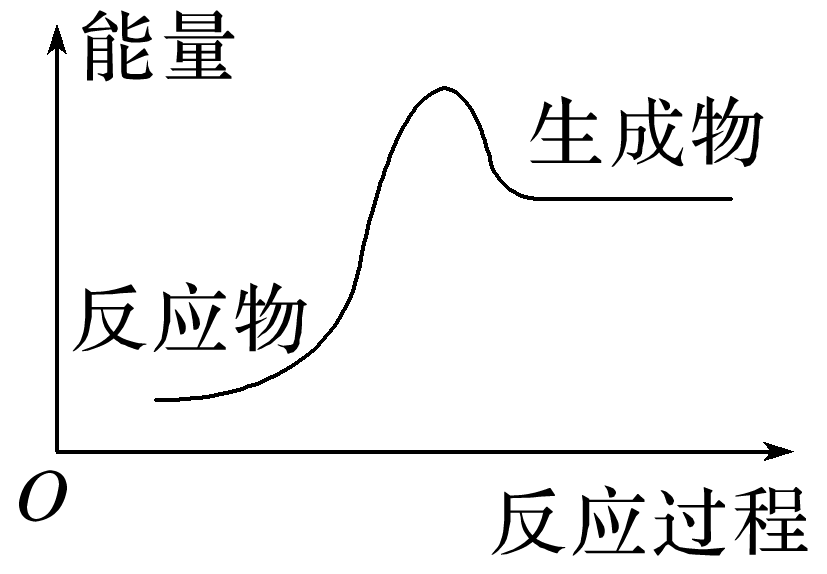
①酸碱中和反应 ②碳酸钙分解 ③金属钠与水反应 ④酒精燃烧 ⑤灼热的碳与二氧化碳反应
⑥Ba·8H2O与NH4Cl反应
(2)H2+Cl2===2HCl的反应过程如图所示:
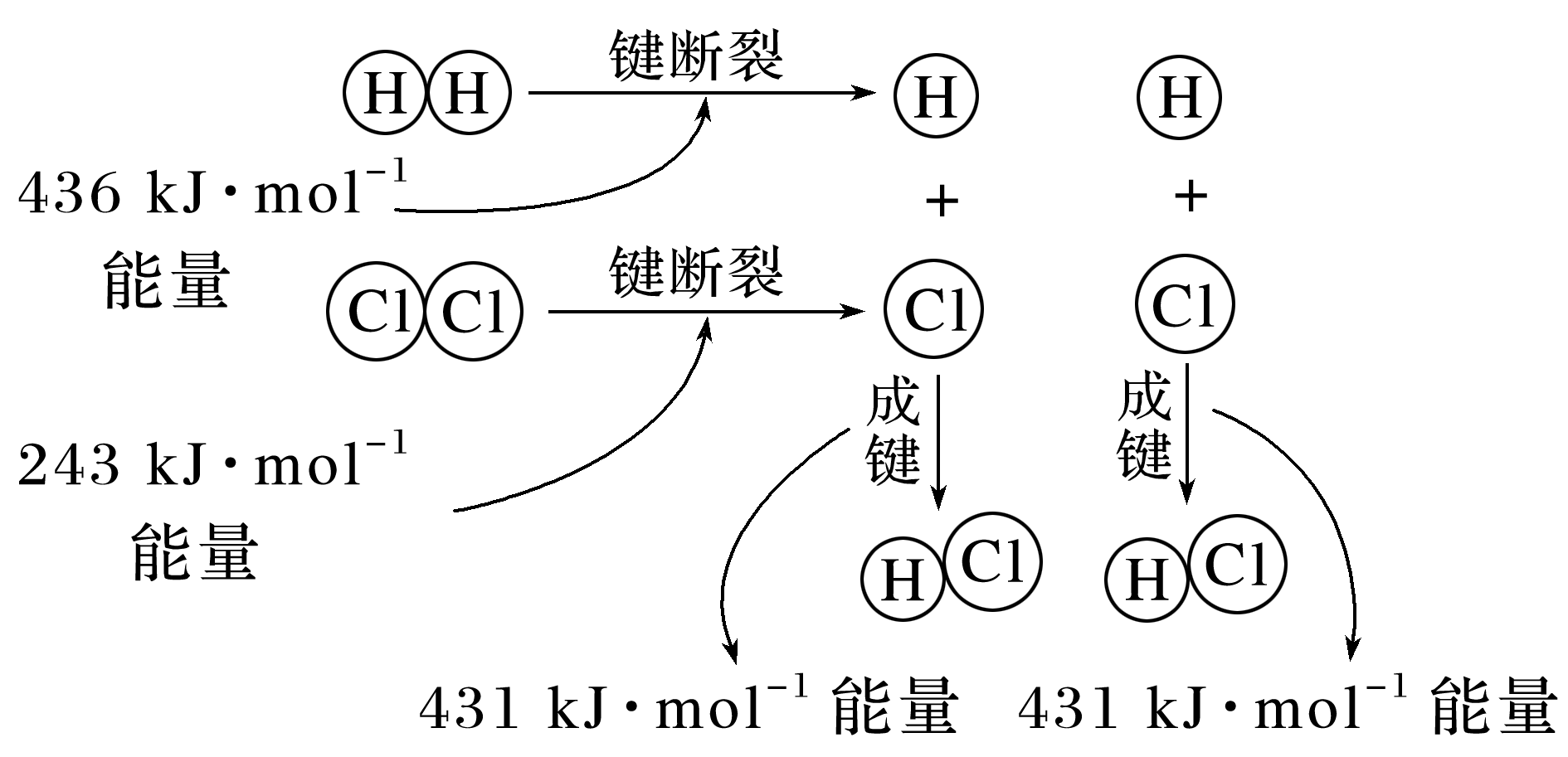
若1 mol H2(g)和1 mol Cl2(g)充分反应,该反应为 (填“吸热”或“放热”)反应。
(3)利用反应Fe+Cu2+===Cu+Fe2+设计一个原电池(正极材料用碳棒)。
①电池的负极材料是 ,负极电极反应式为 ,电解质溶液是 。
②正极上出现的现象是 。
③若导线上转移1 mol电子时,则电解质溶液改变的质量为 g。
答案: (1)②⑤⑥ (2)放热 (3)①Fe Fe-2e-===Fe2+ CuSO4溶液(合理即可) ②碳棒上有红色物质析出 ③4
(1)由图可知,化学反应为吸热反应,故符合能量变化图示的是②⑤⑥。
(2)由信息可知,1 mol H2(g)和1 mol Cl2(g)旧键断裂共吸收243 kJ+436 kJ=679 kJ的能量,生成2 mol HCl(g)共放出431 kJ×2=862 kJ的能量,反应物旧键断裂吸收的能量小于生成物新键形成放出的能量,故该反应为放热反应。
(3)①Fe失电子作负极,电极反应式为Fe-2e-===Fe2+;Cu2+在正极上得电子发生还原反应,所以电解质是可溶性的铜盐。
③由电极反应式可知,若导线转移1 mol电子,则生成0.5 mol铜和0.5 mol Fe2+,电解质溶液改变的质量为0.5 mol×64 g·mol-1-0.5 mol×56 g·mol-1=4 g。
(2024·广西南宁高一期中)电化学原理在电池制造、能量转换、物质合成等方面应用广泛。
(1)微型纽扣银锌电池(如图)在生活中有广泛应用,其电极分别是Ag2O和Zn,电解质为KOH溶液,电极反应分别为Zn+2OH--2e-===ZnO+H2O、Ag2O+H2O+2e-===2Ag+2OH-。
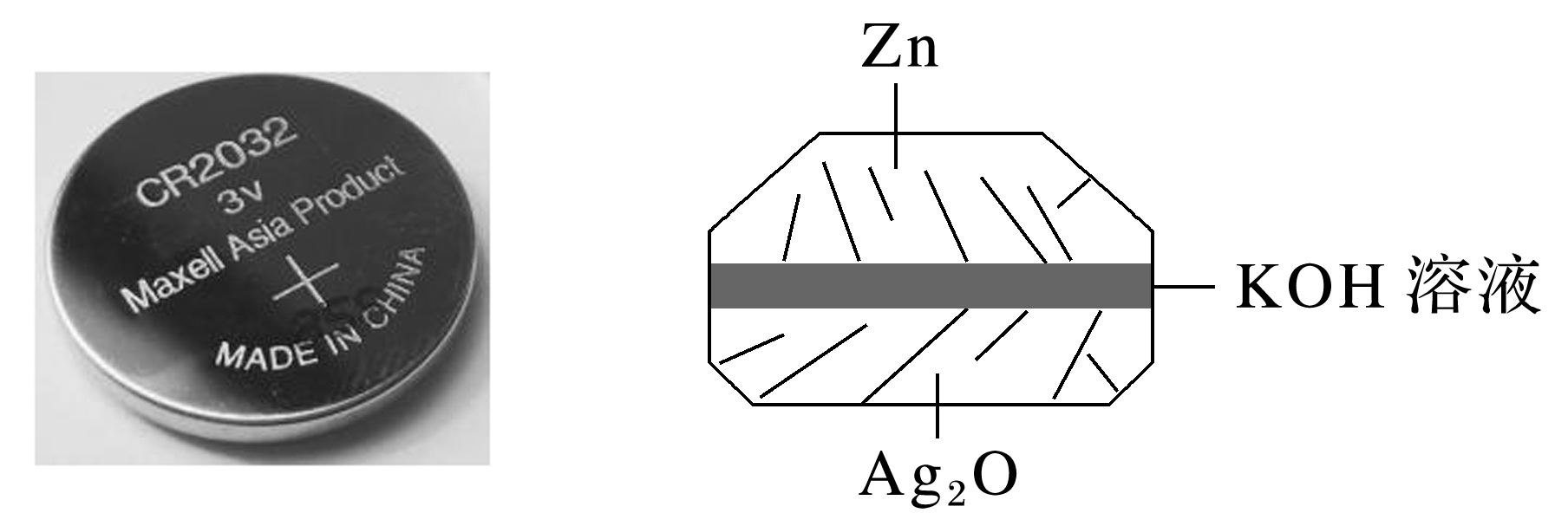
Ag2O是电池的 极,电池的总反应方程式为 。在使用过程中,电解质溶液的pH (填“增大”“减小”或“不变”)。
(2)燃料电池必须从电池外部不断地向电池提供燃料。如甲烷⁃空气燃料电池,工作原理如图甲。a、b均为惰性电极。a为 极,正极的电极反应式为 。当通入4.48 L(标准状况下)甲烷气体完全反应时,测得电路中转移1.2 mol电子,则甲烷的利用率为 。
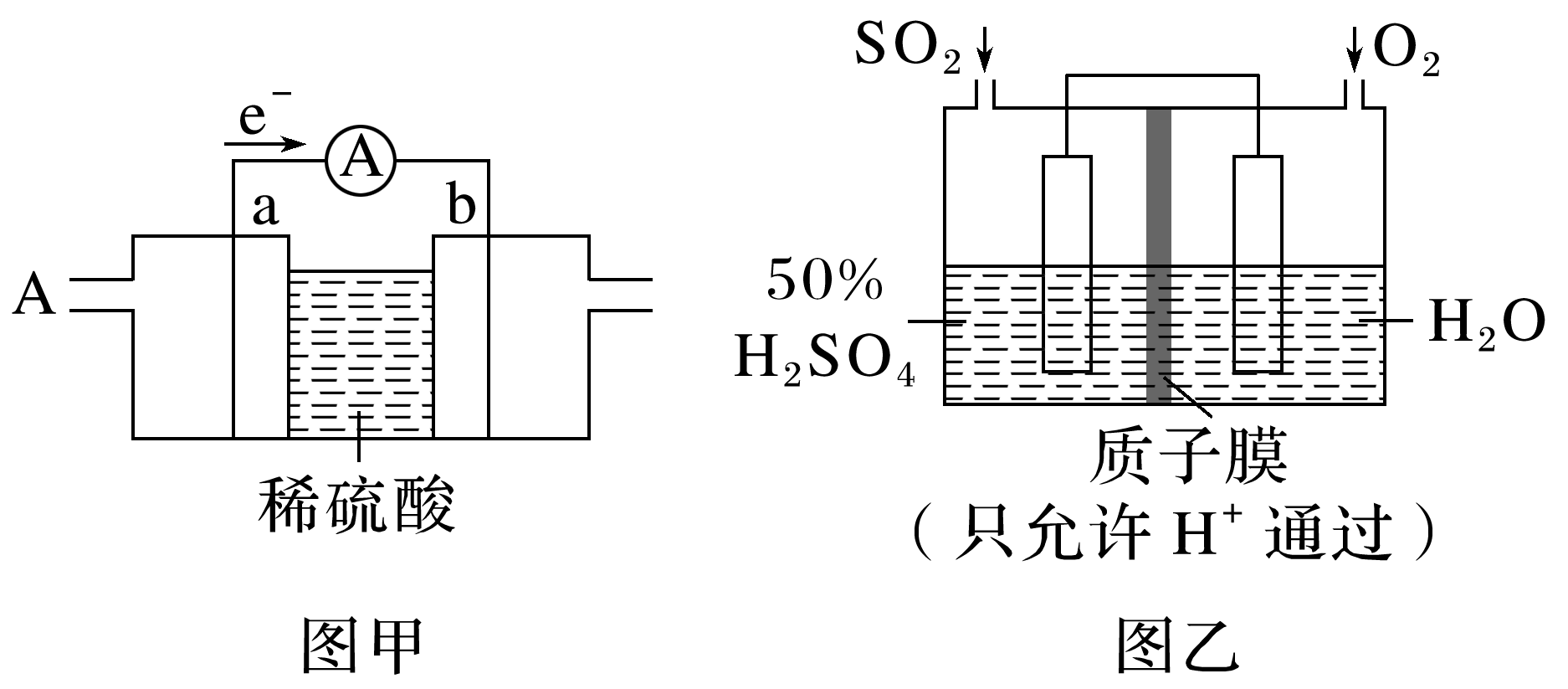
(3)以图乙所示装置可以模拟工业生产硫酸,写出该装置负极的电极反应式: ,若此过程中转移了0.2 mol电子,则理论上质子膜两侧电解液的质量变化差[Δm左-Δm右]为 g(忽略气体的溶解)。
答案: (1)正 Ag2O+Zn===ZnO+2Ag 不变 (2)负 O2+4e-+4H+===2H2O 75% (3)SO2-2e-+2H2O===+4H+ 4.4
(1)Ag2O是电池的正极,锌是负极,根据Zn+2OH--2e-===ZnO+H2O、Ag2O+H2O+2e-===2Ag+2OH-可知电池的总反应方程式为Ag2O+Zn===ZnO+2Ag,因此电解质溶液的pH不变。
(2)电子从a电极流出,所以a为负极,正极是氧气得到电子,则正极电极反应式为O2+4e-+4H+===2H2O。当通入4.48 L(标准状况下)即0.2 mol甲烷气体完全反应时,理论上转移0.2 mol×8=1.6 mol电子,测得电路中转移1.2 mol电子,则甲烷的利用率为×100%=75%。
(3)二氧化硫失去电子作负极,电极反应式为SO2-2e-+2H2O===+4H+,若此过程中转移了0.2 mol电子,依据电子得失守恒可知消耗0.1 mol二氧化硫和0.05 mol氧气,有0.2 mol氢离子从左侧进入右侧,则理论上质子膜两侧电解液的质量变化差[Δm左-Δm右]=(6.4 g-0.2 g)-(0.2 g+1.6 g)=4.4 g。
(2024·武汉高一期中)一定温度下,在2 L的恒容密闭容器中充入1 mol CO和2 mol H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g),测得CO(g)和CH3OH(g)的物质的量随时间变化如图1所示,反应过程中的能量变化如图2所示。
CH3OH(g),测得CO(g)和CH3OH(g)的物质的量随时间变化如图1所示,反应过程中的能量变化如图2所示。
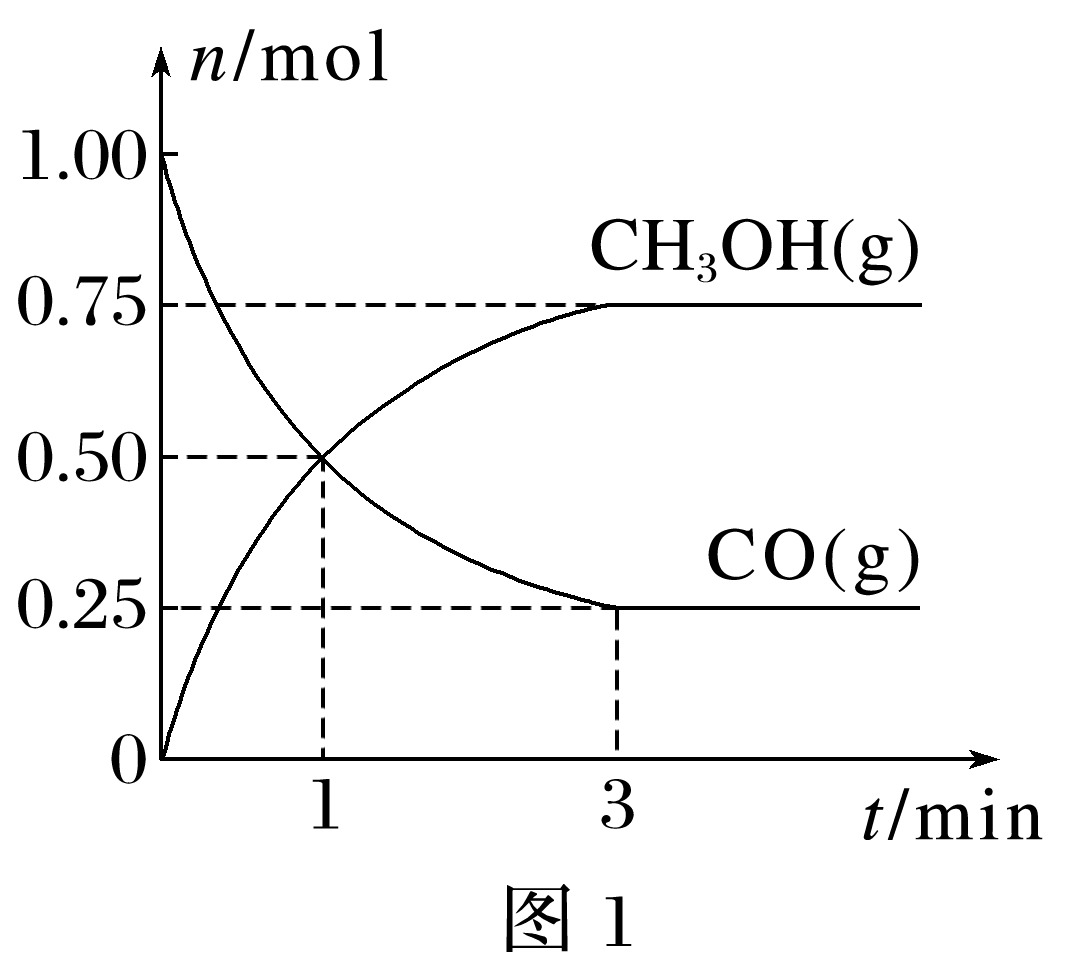
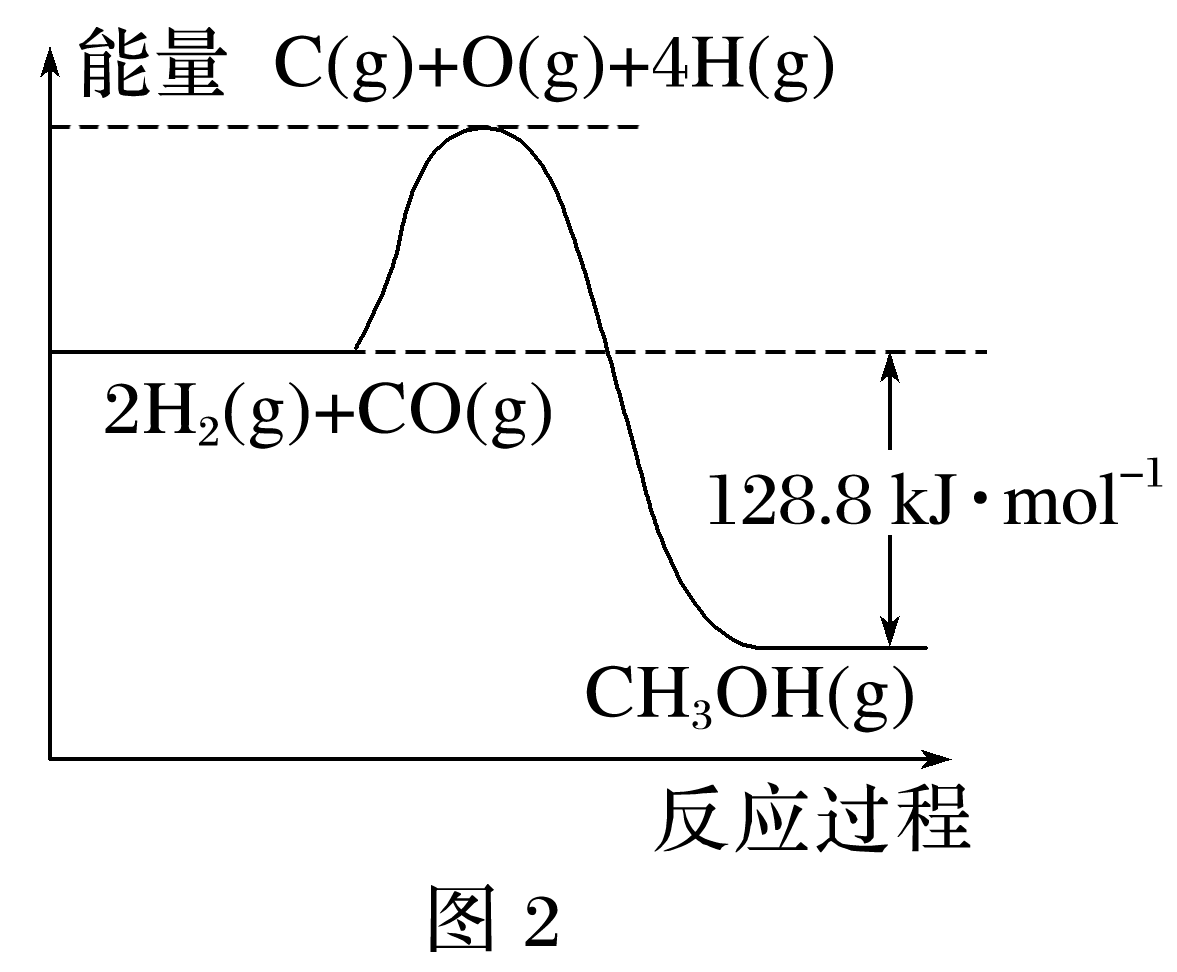
(1)1 min到3 min内,以CO表示的平均反应速率v(CO)= mol·L·min-1。
(2)改变下列条件对反应速率无影响的是 (填字母,下同)。
A.升高温度
B.加入合适的催化剂
C.保持压强不变,充入氩气
D.保持体积不变,充入氩气
(3)下列描述能说明上述反应达到平衡状态的是 。
A.混合气体的密度不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内消耗2 mol H2的同时生成1 mol CH3OH
D.混合气体的平均相对分子质量不随时间的变化而变化
(4)平衡时H2的转化率为 ,平衡时压强与起始时压强之比为 。
(5)已知断开1 mol CO(g)和2 mol H2(g)中的化学键需要吸收的能量为1 944 kJ,则断开1 mol CH3OH(g)中的化学键所需要吸收 kJ的能量。
答案: (1)0.062 5 (2)D (3)BD (4)75% 1∶2 (5)2 072.8
(1)1 min到3 min内,v(CO)===0.062 5 mol·L-1·min-1。
(2)升高温度,加入合适的催化剂,反应速率都增大,A、B错误;保持压强不变,充入氩气,容器体积变大,反应物浓度减小,反应速率减小,C错误;保持体积不变,充入氩气,反应物浓度不变,反应速率不变,D正确。
(3)A项,混合气体的密度为,反应前后都是气体且恒容,则密度不变,不能说明反应达到平衡;C项,单位时间内消耗2 mol H2为正反应速率,生成1 mol CH3OH也是正反应速率,不能说明反应达到平衡。
(4)根据图1可知,平衡时生成0.75 mol CH3OH(g),消耗1.5 mol H2,则H2的转化率为×100%=75%。消耗1.5 mol H2,剩余0.5 mol H2,CH3OH为0.75 mol,CO剩余0.25 mol,反应后气体的总物质的量为(0.75+0.5+0.25) mol=1.5 mol ,根据同温同压下,物质的量之比等于压强之比,所以平衡时压强与起始时压强之比为1.5∶3=1∶2。
(5)根据图2可知,2 mol H2(g)与1 mol CO(g)反应生成1 mol CH3OH(g)放出128.8 kJ能量,断开1 mol CO(g)和2 mol H2(g)中的化学键需要吸收的能量为1 944 kJ,则形成1 mol CH3OH(g)中的化学键所需要放出能量为(128.8+1 944) kJ=2 072.8 kJ,则断开1 mol CH3OH(g)中的化学键需要吸收2 072.8 kJ能量。
(2024·河北保定高一段考)某实验小组用酸性KMnO4溶液和H2C2O4(草酸)反应研究影响反应速率的因素,反应的离子方程式为5H2C2O4+2+6H+===10CO2↑+2Mn2++8H2O。他们通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计方案如下(KMnO4溶液已酸化):

(1)酸性KMnO4溶液中所加的酸应是 (填字母)。
A.硫酸 B.盐酸
C.硝酸 D.以上三种酸都可
(2)该实验探究的是 对化学反应速率的影响。
(3)实验停止前,相同时间内针筒中所得CO2体积较大是 (填实验序号)。
(4)若实验①在2 min末收集到(V-20)mL的CO2,则这段时间内的平均反应速率可表示为v= mL·min-1。
(5)若实验②在t min收集了2.24 mL CO2(标准状况),则t min末的物质的量浓度为 mol·L-1。
(6)该小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:① ,② 。
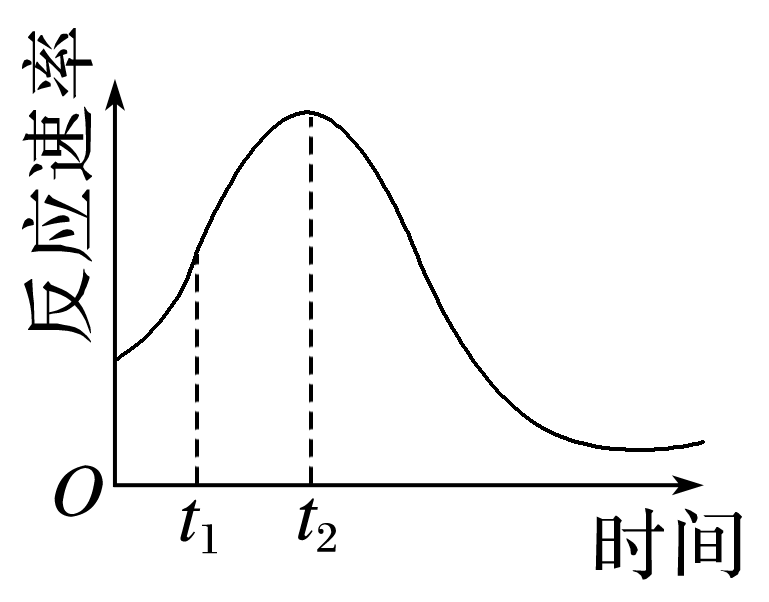
答案: (1)A (2)浓度 (3)① (4) (5)5.6×10-3 (6)反应放热 反应生成的Mn2+起催化作用
(1)酸性KMnO4溶液中所加的酸应是硫酸,因为盐酸有还原性,能被KMnO4氧化,硝酸本身有强氧化性,也不合适,故A符合。
(3)①中A溶液的浓度比②中大,化学反应速率大,所得CO2的体积较大的是①。
(5)若实验②在t min收集了2.24 mL CO2(标准状况),n(CO2)= mol=0.000 1 mol,根据离子方程式5H2C2O4+2+6H+===10CO2↑+2Mn2++8H2O可知,反应掉的n(KMnO4)=0.000 1 mol×=2×10-5mol,则t min末n(KMnO4)=30×10-3 L×0.01 mol·L-1-2×10-5mol=0.000 28 mol,的物质的量浓度为=5.6×10-3mol·L-1。