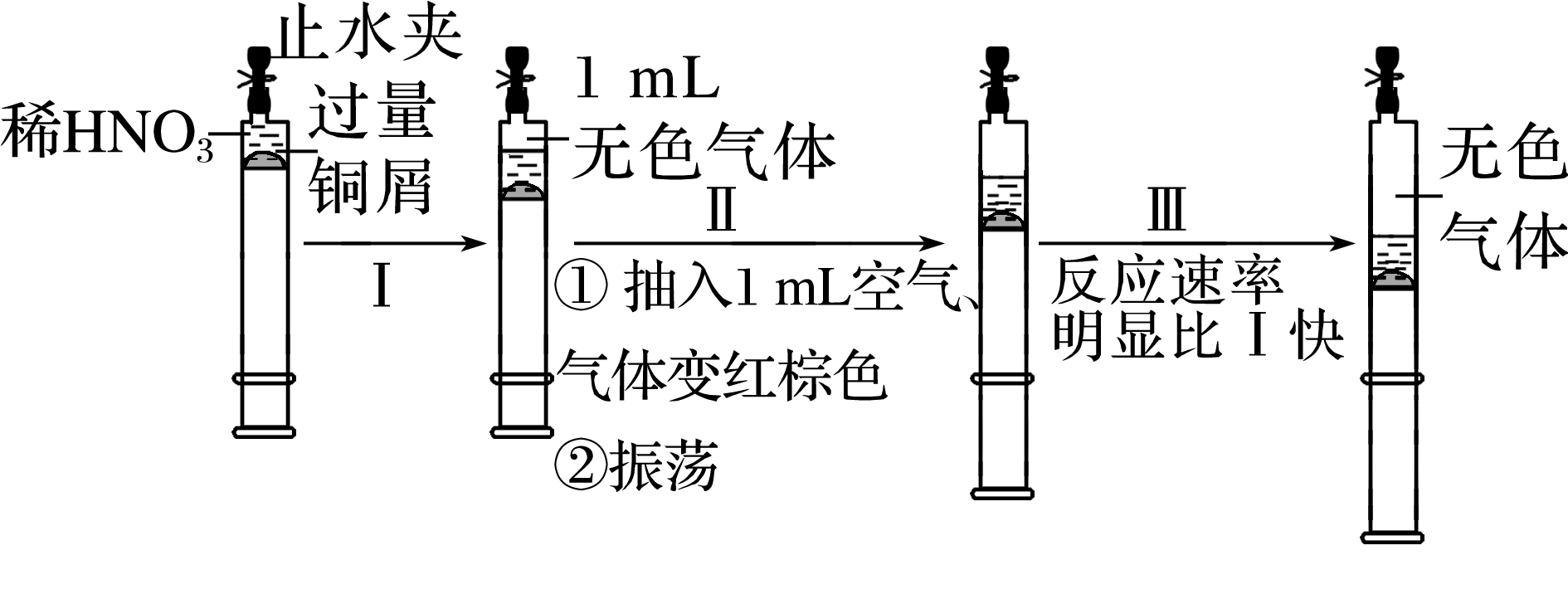
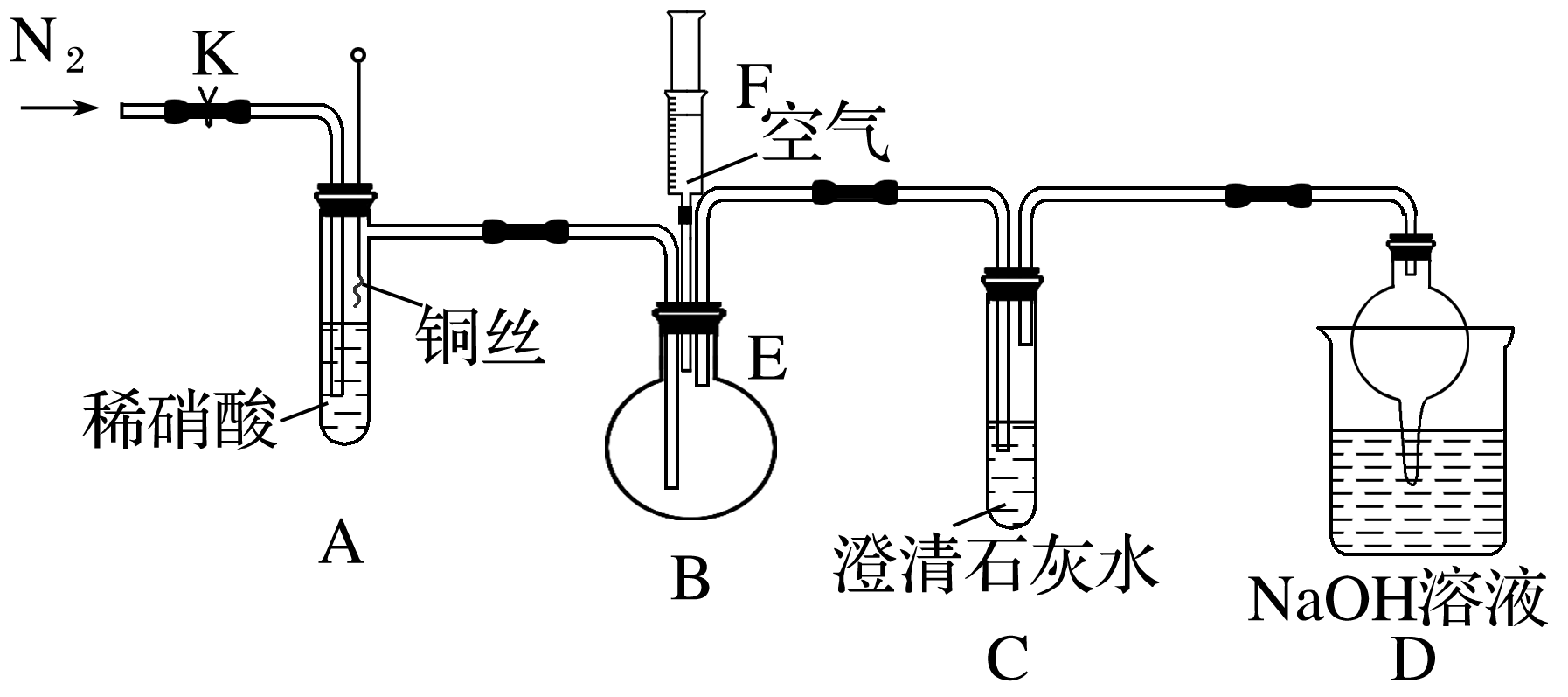
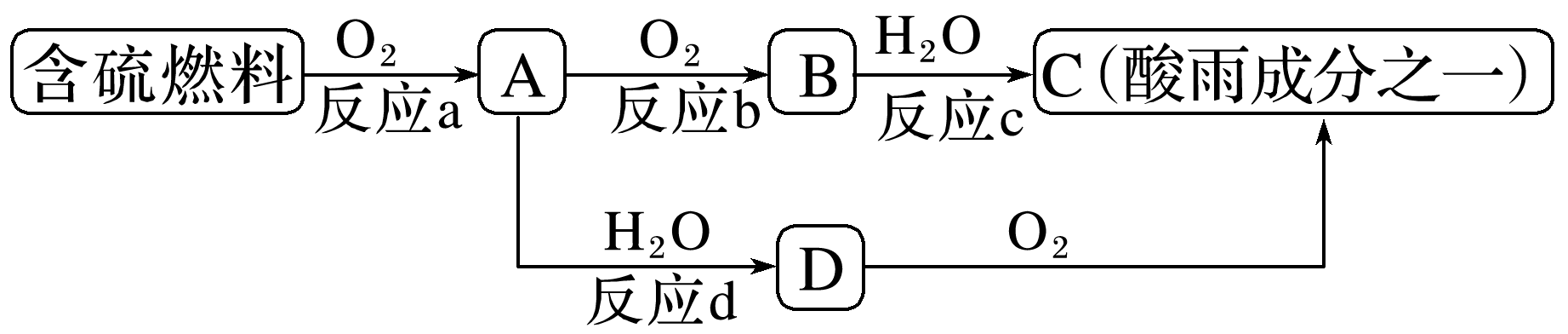
下列有关反应4HNO3(浓)![]() 4NO2↑+O2↑+2H2O的说法正确的是( )
4NO2↑+O2↑+2H2O的说法正确的是( )
- A: 该反应与4NO2+O2+2H2O
 4HNO3(浓)互为可逆反应
4HNO3(浓)互为可逆反应 - B: 浓HNO3具有强氧化性,可与金属Au、Pt和Ti反应
- C: 常温下,冷的浓硝酸可使铜和铝等金属表面形成致密的氧化膜而钝化
- D: 质量分数为63%的硝酸(密度1.42 g·cm-3)的物质的量浓度为14.2 mol·L-1
该反应与4NO2+O2+2H2O![]() 4HNO3(浓)反应条件不同,不互为可逆反应,A错误;浓HNO3具有强氧化性,不可与金属Au、Pt反应,可与Ti反应,B错误;常温下,冷的浓硝酸可使铁和铝等金属钝化,不能使铜钝化,C错误;该硝酸物质的量浓度为c==mol·L-1=14.2 mol·L-1,D正确。
4HNO3(浓)反应条件不同,不互为可逆反应,A错误;浓HNO3具有强氧化性,不可与金属Au、Pt反应,可与Ti反应,B错误;常温下,冷的浓硝酸可使铁和铝等金属钝化,不能使铜钝化,C错误;该硝酸物质的量浓度为c==mol·L-1=14.2 mol·L-1,D正确。